整備士ドットコム
Jidoshaseibishi.com
複数条件の場合はキーワードの間にスペースを入れてください。2級ガソリン自動車整備士・試験問題
充・放電時のバッテリの化学反応式を示す下の(イ)~(ニ)に当てはまるものとして,下の組み合わせのうち適切なものはどれか。
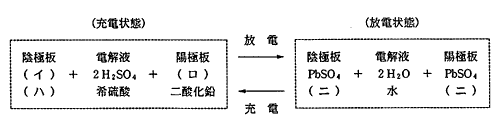
解説
二級からの出題です。
正解は(4)です。
受験テクニック上は、答えを丸暗記した方が良いでしょう。
以下は興味がある場合のみにして頂ければと存じます。
ここから少し説明が長くなりますが、反応式を求めてゆきます。
鉛蓄電池は、酸化還元反応を応用したものです。
酸素の原子構造です。
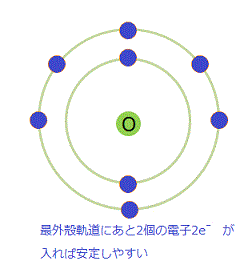
図 酸素原子
L核の電子は、6個です。
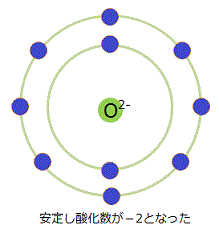
図 酸素イオン
他から電子2個もらって安定しる酸素イオンになります。
酸素の酸化数は-2です。
ここで出てくるイオンは、H+の水素イオンがあります。
PbO2は、イオンで表せばPb4+O2-O2-となります。
このように化合物の酸化数は(+4)+(-2)×2=0 となります。
更に電解質の希硫酸はH2SO4は 2H+SO42-で表せますが、負極Pbと正極PbO2とそれぞれ反応しますので、2セット必要となりすなわち
4H++2SO42-又は
H++H++H++H++SO42-+SO42-
の形で計算されます。
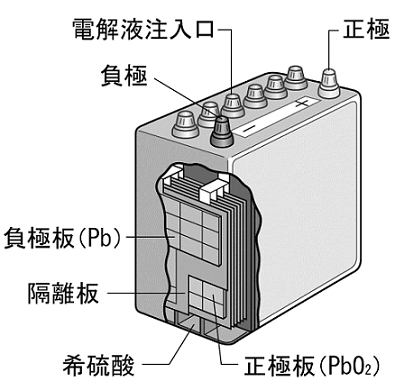
図 鉛蓄電池
鉛蓄電池は、酸化還元反応を巧みに利用した二次電池です。
| 酸化 | 還元 | |||
| Pb | → | Pb2+ | ← | Pb4+ |
|
|
||||
| 0 | 2 | 4 | ||
| 酸化数直線 | ||||
一般に金属はPb2+のように+2価で安定になります。
以上で各イオンと原理が分かり段取りができました。
負極と正極に負荷を接続した瞬間に、負極と正極は次のような反応が生じます(半反応式)。
負極 |
正極 |
上の式が鉛蓄電池の原理式です。
いずれも右辺がPb2+になっています。
あとは上の式に正極にのO2-と希硫酸イオン SO42-の関係を調整していけばよいことになります。
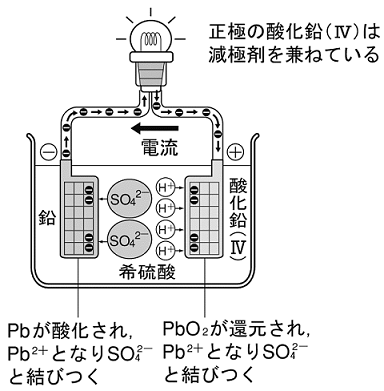
図 電解液のイオン
さて放電時、負極では、Pbが酸化されてPb2+になるが、直ちに液中のSO42-と結合して不溶性のPbSO4になり極板に付着します。
極板にPbSO4が付着すると極板とH2SO4との接触面積が少なくなり起電力が低下します。
充電を考えると、PbSO4が水に不溶で極板への付着は、優先的に逆反応が生じ起電力を回復できるので誠に画期的なことです。
これが鉛蓄電池が1859年にプランテ(フランス)が発明し、今日まで利用されている理由はここにあります。
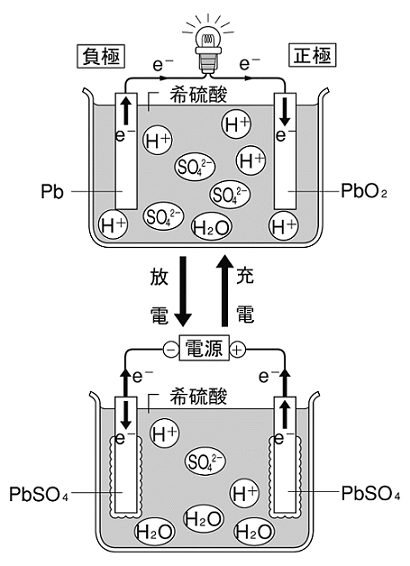
図 鉛蓄電池の放電と充電
正極でもPbSO4極板への付着が生じます。
①式の両辺にSO42-を加算します。
Pb+SO42-→Pb2++SO42-+2e-
→PbSO4+2e- …③
正極は、鉛イオンの他に電解液中の水素イオンの反応を考えます。
負極から出た電子2e-は負荷を通って正極に入り、正極と反応してPb4+と2O2-が電解液中に生じます。
まず最初に②式の両辺に正極にある2個の酸素イオン2O2-を足します。
Pb4++2O2-+2e- → Pb2++ 2O2-
PbO2+2e- → Pb2++ 2O2-
更に上式の両辺にSO42-を足します。
PbO2+SO42-+2e-→Pb2++SO42-+2O2-
PbO2+SO42-+2e- →PbSO4+2O2-
最後の上式の両辺に水素イオンを足します。
PbO2+4H++SO42-+2e-→PbSO4+4H++2O2-
PbO2+4H++SO42-+2e-→PbSO4+2H2O …④
③と④式で2e-を消去し全体の反応式を求めます。
Pb+SO42- → PbSO4+2e-
+ PbO2+4H++SO42-+2e- → PbSO4+2H2O
| Pb | + PbO2 | + 2H2SO4 | → | PbSO4+ | 2H2O |
| 海綿状鉛 | 二酸化鉛 | 電解液 | 硫酸鉛 | 水 |
上の式の矢印を←に換えれば充電反応式です。
充電すると負極に付着していたPbSO4が還元されてPbに、正極に付着していたPbSO4は酸化されてに変化する一方、硫酸の濃度も元通りになり、起電力が回復します。
二級に教科書に過充電で陰極に水素ガスが発生する記述があります。
陰極: |
| 水素ガス |
H2SO4を2H++SO42-で表し①式を用いると上式は、
Pb2++ 2e- +2H++SO42-
Pb2++SO42-+2e-+2H+→ PbSO4 + H2↑
となります。
教科書は、結果のみ記述されています。
陽極: |
| 酸素ガス |
酸素分子が分かりやすく計算しやすいように両辺全体を2倍にしましょう。
陽極:
2PbO2+2H2SO4→ 2PbSO4+2H2O+O2↑
右辺をイオン式で書けば
2Pb4++ 2O2-+2O2-+4H++2SO42-
2Pb4++2(O+2e-)+2(O+2e-)+4H++2SO42-
2Pb4++2×2e-+2×2e-+4O+4H++2SO42-
さらに
2Pb2++2SO42-+ 4H+ 4O
結局、陽極から酸素がでるということですが、化学反応式のでやればあっさり出る結論でしたね。
こんなやり方も珍しいかもしれないと思い書いてみました。
最後になりますが、電解液H2SO4は不揮発性ですので、蒸発することはありませんが、H2Oは蒸発したり、、充電時にいくらかの水の電気分解がおこるため、H2、O2となって空気中に失われていきます。よって、極板の上端が常に液面より下にあるように純水を補給します。
シールド型の鉛蓄電池は、充電時に発生するH2、O2を蓄電池内部で消費するように工夫することで密閉化が可能になりました。
負極の海綿状鉛はを吸収するので通気性に優れた特別なセパレータを用いることで正極に発生したO2を負極上へ導き、水に変えるとともに、H2の発生も抑制しています。
以上の関係式を示しておきます。
Pb + 1/2O2 + H2SO4 → PbSO4+H2O
負極 ↑ 希硫酸
正極で発生したO2を負極に導入
計算し難いので、上式左辺を2倍します。
2Pb + O2 + 2H2SO4
ここでPbはPb2+ + 2e-で表すことができますので
上式は、
2(Pb2++2e-)+O2+2(2H++SO42-)
2(Pb2++SO42-)+O2+4e-+4H+
2PbSO4+2H2O
すなわち、硫酸鉛と水になりました。
自動車整備士の化学問題